Lo so che il precedente sarebbe dovuto essere l'ultimo post, ma sapete com'è, la vita riserva delle sorprese. Così in questo ultimo post (prometto che sarà l'ultimo) posterò un paio di palindromi inerenti la chimica. Innanzitutto, un palindromo è una parola che può essere letta sia da sinistra a destra che da destra a sinistra, senza mutare il suo significato. Eccoli:
- anilina
- oro
Lo so, sono solo due, ma non è stato semplice trovarli, soprattutto il primo. Chissà, magari riuscirete a trovarne alcuni che mi sono sfuggiti.
Vi ringrazio ancora per aver seguito il mio blog, e spero che vi sia piaciuto.
Tecnologia & Chimica : quando la tecnologia incontra la chimica
domenica 16 giugno 2013
domenica 9 giugno 2013
Siamo arrivati alla fine
In questo blog è stato affrontato il rapporto fra tecnologia e chimica. Per prima cosa sono partito analizzando la chimica attraverso un abbecedario. Nel seguito ho cercato di dare una definizione di chimica e ho dato alcune traduzioni del nome chimica. Dopo di che, ho parlato dello stato iniziale della chimica, parlando dell'alchimia analizzandone lo sviluppo nel tempo (dalla cina, passando per il mondo greco romano e arrivando fino al medioevo e oggi). In chimica un materiale molto utile è il vetro, usato per la maggior parte degli strumenti. Ho anche parlato della chimica che è alla base degli inchiostri, e ho fatto un percorso che mi ha portato a trovare la chimica in diversi ambiti (arte, filatelia e fumettistica, musica, cucina e cosmesi). Come ogni campo del sapere umano, anche la chimica ha i suoi esponenti, che sono più o meno famosi, che hanno fatto scoperte più o meno casuali. La chimica può anche essere studiata attraverso i suoi simboli e la sua storia (nel caso della chimica, anche quella degli elementi chimici), ma anche attraverso grafici e carte geografiche. Inoltre si è parlato anche dell'elettrochimica (mostrandone anche dei brevetti).
Spero che vi sia piaciuto questo blog e che vi abbia incuriosito facendovi scoprire cose che magari non sapevate o a cui non avevate mai pensato. Arrivederci.
Spero che vi sia piaciuto questo blog e che vi abbia incuriosito facendovi scoprire cose che magari non sapevate o a cui non avevate mai pensato. Arrivederci.
venerdì 7 giugno 2013
Chimica e bellezza: il rossetto.
In questo post, prendendo spunto dal libro protagonista del blog, parlerò di un oggetto di bellezza che le donne conoscono bene.
Il capitolo che ha ispirato questo post è quello intitolato "Azoto", perché in questo capitolo si parla di ricavare Allosana, composto ricavato dall'acido urico, che si
trova presente al 50% negli escrementi degli uccelli e fino al 90% negli escrementi dei serpenti (infatti, espellere azoto allo stato solido attraverso l'acido urico, era uno stratagemma adottato per espellere l'azoto in eccesso evitando perdite di acqua in luoghi in cui essa era preziosa, tipo i deserti) per produrre un rossetto la cui colorazione sia permanente e non sbavi sottoposto al calore delle labbra.
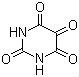 |
| formula chimica dell'allossana |
trova presente al 50% negli escrementi degli uccelli e fino al 90% negli escrementi dei serpenti (infatti, espellere azoto allo stato solido attraverso l'acido urico, era uno stratagemma adottato per espellere l'azoto in eccesso evitando perdite di acqua in luoghi in cui essa era preziosa, tipo i deserti) per produrre un rossetto la cui colorazione sia permanente e non sbavi sottoposto al calore delle labbra.
L'allossana, a contatto con le mucose, conferisce loro una colorazione rossa permanente, perché non è una sovvrapposizione, una vernice insomma, come il rossetto, ma una vera e propria tintura, come si fa con la lana e il cotone.
Primo Levi, "Il Sistema Periodico", "Azoto", Editore Einaudi : Torino, 2005
Adesso vi elencherò i principali componenti chimici del rossetto:
- pentaeritrile, un acido grasso che ha la funzione di idratare le labbra
- metilparaben, un estere che ha la funzione di antimicotico, quindi serve a conservare il prodotto (viene usato anche negli alimenti)
- propilparaben, un altro estere con le stesse funzioni di quello precedente
- butilidrossitoluene, un fenolo alchilato che ha la funzione di evitare l'ossidazione dei grassi contenuti nel rossetto
- meticone, silicone per rendere meno attaccabile da agenti esterni il rossetto
- geraniolo, un alcolo estratto dai gerani ed è usato per il suo gradevole odore
- starato di ottildodecile, un emolliente che rende meno secche le labbra
- olio di ricino idrogenato, rende uniforme il colore del rossetto
- tocoferolo acetato, protegge le labbra dai raggi U.V.
- retinolo palmitato è un estere che funge da antiossidante
- cera d'api per dare una struttura al rossetto
giovedì 6 giugno 2013
la chimica del... cheeseburger
In questo post vi linkerò la pagina nella quale sono contenuti video che hanno come tema la chimica che si nasconde dietro ogni elemento di un cheeseburger.
Buona visione!
sabato 1 giugno 2013
finalmente i brevetti
In questo post metterò, anche se in ritardo (come dice il professore, gli ingegneri sono sempre gli ultimi ad arrivare), alcuni brevetti concernenti l'argomento di due post fa: l'elettrochimica. Purtroppo metterò i link a questi brevetti, visto che non sono riuscito a postare le immagini.
setto poroso per celle elettrochimiche
cella elettrolitica
cella galvanica
pila di volta
setto poroso per celle elettrochimiche
cella elettrolitica
cella galvanica
pila di volta
venerdì 31 maggio 2013
La musica ... della chimica
Mercoledì il professore ci ha fatto ascoltare delle melodie prodotte dalla chimica (le prime due melodie) e le melodie successive invece erano melodie atte ad enfatizzare i valori esoterici di questa scienza. Per comodità ho posto i link di alcune di queste melodie, spero vi piaceranno.
rane chimiche
vento chimico
alchimia_1
alchimia_2
alchimia_3
alchimia_4
alchimia_5
alchimia_6
alchimia_7
alchimia_8
alchimia_9
rane chimiche
vento chimico
alchimia_1
alchimia_2
alchimia_3
alchimia_4
alchimia_5
alchimia_6
alchimia_7
alchimia_8
alchimia_9
L'elettrochimica
In questo post tratterò il processo chimico che si cela dietro una branca della chimica nata tra la fine del 700' e l'inizio del 800': l'elettrochimica.
Come detto essa è una branca della chimica e della fisica che si interessa del rapporto che esiste fra energia elettrica ed energia chimica. Il dispositivo principe dell'elettrochimica è la pila:
Essa è un dispositivo inventato da Alessandro Volta nel 1799, che era formata da una pila di dischi di zinco e rame alternati ad un disco imbevuto di una soluzione salina. Fu però grazie a Luigi Galvani che Volta si interessò a questi fenomeni: infatti Galvani aveva eseguito esperimenti sulle rane, sostenendo che l'elettricità fosse un fenomeno con origini solo biologiche.
Una pila, in generale, è composta da due elettrodi (nella maggior parte dei casi allo stato solido, come ad esempio barrette di metallo) che sono collegati attraverso un collegamento elettrico (che permette il passaggio di elettroni). I due elettrodi (chiamati anodo quello con carica negativa e catodo quello con carica positiva) sono immersi in due diverse soluzioni elettrolitiche (composte dagli ioni dell'elettrodo, come ad esempio sbarretta di rame in soluzione di ioni rame) e queste soluzioni (che sono in due contenitori divisi, dette celle) sono collegate attraverso un setto poroso con all' interno una sostanza che dissociandosi evita il cortocircuito della pila (detto ponte salino). Questa pila funziona con una reazione chimica, chiamata di ossido-riduzione (o redox): essa consiste in uno passaggio di elettroni da una sostanza all'altra (con variazione del numero di ossidazione), che si trasferiscono dalla sostanza che si ossida a quella che si riduce. La reazione netta della pila presentata nella figura è:
Portale elettrochimica di Wikipedia
Elettrochimica nell'enciclopedia Treccani
 |
| la copertina di un libro di elettrochimica del 1907 |
"Alle soglie del XIX secolo Alessandro Volta costruisce la pila, gettando le basi dell'elettrochimica: è, all' epoca, difficile scorgere in questa nuova branca della fisica la presenza degli stessi principi di conservazione e non generazione spontanea dell'energia. La corrente elettrica, generata dalla reazione dell'elettrolito a contatto con gli elettrodi, a lungo viene ritenuta inesauribile. E' un' eccezione che nel 1832 il chimico Roget affermi nel suo Galvanism affermi che "tutte le sorgenti di potenza e di moto, quando producono il loro effetto, esauriscano le risorse da cui detti effetti sono prodotti", generalizzando così l'impossibilita di qualsiasi moto perpetuo"
Vittorio MARCHIS, Storia delle Macchine, Editori LaTerza : Roma-Bari, 2005
 |
| Appunti originali di A. Volta con schema della sua pila |
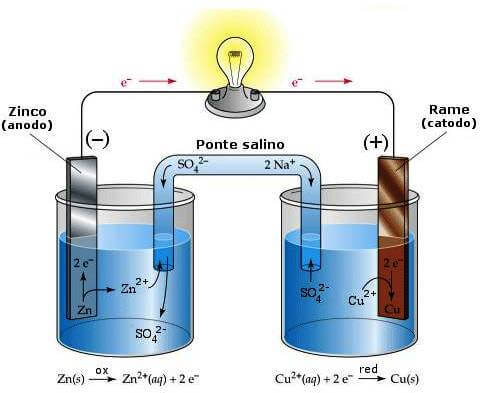 |
| schema di una pila Daniell |
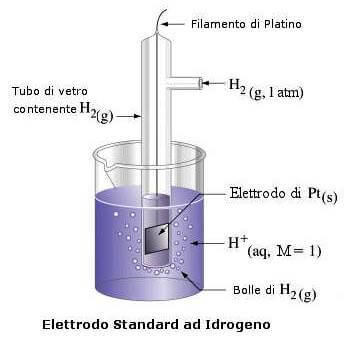
Queste reazioni, però, avvengono solo se la differenza di potenziale tra i due elettrodi è abbastanza elevata, in base ad una scala dei potenziali dei potenziali di riduzione standard (25°C e 1 atm) rispetto ad un elettrodo preso come standard (quindi potenziale 0.0 V), che è l'elettrodo ad idrogeno.
 |
| potenziali di riduzione standard di alcuni metalli |
Vi metto un paio link e qualche video che renderanno più completo il mio post, che per motivi pratici non poteva essere completo:Portale elettrochimica di Wikipedia
Elettrochimica nell'enciclopedia Treccani
Iscriviti a:
Post (Atom)